
癌细胞的转移与其躲避免疫细胞打击、降解细胞外基质(ECM)息息相关。尽管肿瘤免疫微环境在影响癌细胞免疫逃逸和转移方面的重要性已得到充分证实,但过去的研究主要侧重于生物化学层面上,微环境中物理因素的作用在很大程度上尚未探索,特别是ECM所介导的癌细胞与免疫细胞之间的力学相互作用是否影响、如何影响癌细胞的免疫逃逸尚不清楚。
近日,北京航空航天大学机械工程及自动化学院徐晔教授课题组与中国科学院物理研究所叶方富研究员、樊琪慧副研究员,以及国科温州研究院王晓晨副研究员合作,构建了一种基于I型胶原蛋白水凝胶的准三维(quasi-3D)体外共培养模型,深入探究了巨噬细胞对两种具有不同转移潜能的结直肠癌细胞(CRC)的追踪响应。相关工作以“Physical immune escape: Weakened mechanical communication leads to escape of metastatic colorectal carcinoma cells from macrophages”为题发表在《美国国家科学院院刊(PNAS)》上。
通过构建基于胶原的体外共培养模型(图1 A),该研究发现不同转移潜能的CRC细胞对巨噬细胞的吸引效果存在较大差异:低转移潜能的SW480对巨噬细胞的吸引效果较高,而转移潜能较高的SW620反之。而在硬质培养皿上,两种CRC细胞的吸引效果相同,均处于较低水平(图1 B和C)。为了探究胶原蛋白ECM如何影响CRC细胞的吸引效果,研究团队观察了CRC细胞周围的胶原蛋白结构,发现了SW480对胶原蛋白明显更强的重构能力,其附近的胶原蛋白网络呈现明显重排列(图1 D)。利用牵引力显微技术(TFM)粒子图像测速法(PIV),研究团队进一步定量表征了两种CRC细胞对胶原蛋白ECM的重构幅度(图1 E-H)。
利用流场扰动方法和人工力学刺激方法,研究团队之前发现巨噬细胞对癌细胞的靶向追踪行为并不完全依赖于癌细胞生化信号,ECM力学信号协同调控了巨噬细胞对癌细胞的定向迁移,并进一步揭示了机械敏感离子通道蛋白与钙信号通路在调控巨噬细胞的力学感应-定向迁移时具有关键的指导性作用(Advanced Functional Materials 2023,33,2211807)。基于两种CRC细胞的重构能力与吸引效果的对应关系,研究团队初步猜测:巨噬细胞对癌细胞的追踪响应与ECM的重构幅度相关。
为了验证这一猜测,研究团队采用显微操作系统模拟癌细胞对基质的重构行为,结果证明更强的ECM力学信号(即重构幅度)能够显著调升巨噬细胞的相关响应行为(图2 A-E),揭示了巨噬细胞靶向追踪行为中的力学响应机制。为了进一步验证ECM介导的力学信号在CRC细胞免疫逃逸中的作用,研究团队通过使用小干扰RNA(siRNA)来降低SW480细胞的E-钙粘蛋白表达,以提高其转移能力(图2 F)。结果证明,相较于阴性对照组,低表达E-cadherin的SW480显著降低了对胶原蛋白ECM的重构幅度(因为整合素α1β1在siEcad-SW480中的表达也相应减少),伴随着吸引效果的显著抑制(图2 G-I)。
综上,本文的研究结果表明,CRC细胞的牵引力会极大地影响巨噬细胞的靶向效率,而减弱的力学通讯使具有更高转移潜力的CRC细胞能够躲避巨噬细胞,从而增强免疫逃逸。这一发现可以为针对癌细胞的免疫反应提供有价值的新见解,并为未来癌症免疫治疗策略提供重要参考。
我院与中国科学院物理研究所联合培养的博士研究生杨宸为本文的第一作者,北京航空航天大学徐晔教授、中国科学院物理研究所叶方富研究员、樊琪慧副研究员,以及国科温州研究院王晓晨副研究员为本文的共同通讯作者。本研究获得了国家自然科学基金委、科技部重点研发计划、中国科学院的资助。
原文链接: https://www.pnas.org/doi/10.1073/pnas.2322479121
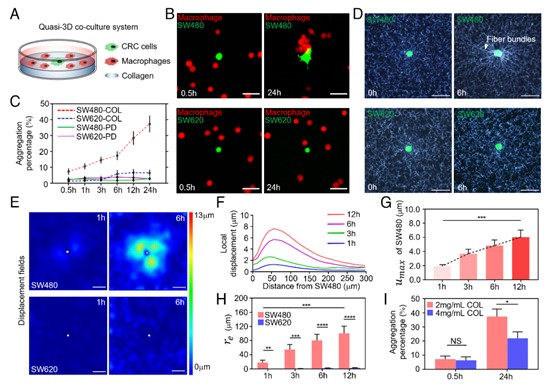
图1.(A)共培养系统。(B)共培养荧光图像。(C)CRC细胞对巨噬细胞的吸引比例。(D)CRC细胞周围的胶原纤维网络。(E)CRC细胞周围的ECM形变场。(F)ECM局部形变幅度(位移)与SW480距离的关系。(G)ECM形变场中的形变最大值umax。(H)CRC细胞对ECM的有效重构半径re。(I)不同浓度胶原蛋白ECM上的吸引比率。
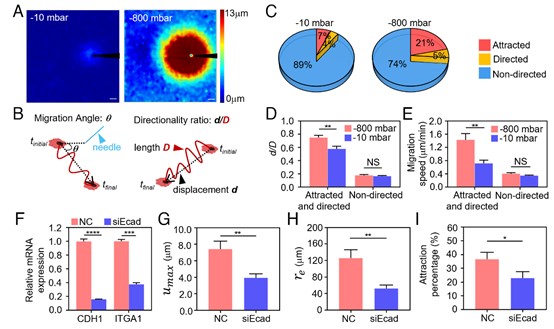
图2.(A)人工形变场。(B)迁移方向角θ和轨迹线性度d/D的定义。(C)巨噬细胞对人工施力源的吸引比率。(D)不同类别巨噬细胞的轨迹线性度d/D和(E)迁移速度。(F)NC(阴性对照)和siEcad(靶向E-cadherin的siRNA)组中E-cadherin(CDH1)和α1-integrin(ITGA1)的相对mRNA表达。(G)NC和siEcad组中SW480的umax和(H)re。(I)NC和siEcad组中SW480的吸引程度。